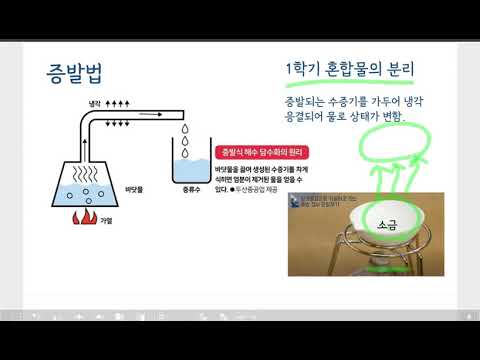
콘텐츠

물 때문에 지구상의 생명이 가능합니다. 지구 표면의 약 70 %는 물로 구성되어 있으며 지구 물의 97 %는 바다에서 발견됩니다. 물은 액체, 기체 및 고체의 세 가지 상태 모두에서 자연적으로 발생하는 지구상의 유일한 물질입니다. 대서양은 모든 해양 중에서 가장 염도가 높지만 사해는 지구상에서 가장 염분이 많은 수역입니다.
밀도
해수는 미네랄 소금이 녹아 있기 때문에 담수보다 밀도가 높고 질량이 더 많습니다. 담수의 밀도는 평방 미터당 1,000kg이고, 해수는 소금으로 인해 평방 미터당 1,027kg의 평균 밀도를 가지며, 이는 소금의 양과 물의 양에 따라 더 높거나 낮을 수 있습니다. 수온. 물이 차가울수록 밀도가 높아집니다. 사해는 가장 밀도가 높은 수역으로 사람들이 다른 수역보다 더 쉽게 떠 다니는 이유입니다.또한 바닷물이 밀도가 높기 때문에 담수와 바닷물이 만나면 담수가 소금 위에 뜬다.
염분
물이 짠 것으로 간주 되려면 물 1,000 부당 소금이 1 부 이상 있어야합니다. 오대호와 같은 모든 담수호는 그보다 소금이 적습니다. 바다는 물의 천 부분 당 평균 35 부분의 소금을 차지하지만 소금물의 종류는 다양 할 수 있습니다. 사해는 거의 300 개에 달하는 부분으로 거의 30 %의 소금을 구성하고 발트해는 7 개 부분으로 만 구성됩니다. 바닷물조차도 얼고 그럴 때 얼음에 소금을 넣을 공간이 거의 없기 때문에 소금이 압축되기 때문에 얼음의 소금 함량이 감소합니다.
녹는 점과 어는점
해수는 담수보다 낮은 온도 (섭씨 2도 대 섭씨 0도)에서 얼고 더 높은 온도에서는 섭씨 102도 (섭씨 100도)에서 끓습니다. 해수는 물 분자 주위에 분자 군의 이온이 응집되어 직접 연결하기 어렵 기 때문에 담수보다 낮은 온도에서 얼어 연결되기 위해서는 온도가 더 낮아야합니다. 그렇기 때문에 얼음이 많은 도로에서 소금을 사용하여 물과 눈의 동결 온도를 낮추는 것입니다. 해수는 응집 된 분자 그룹이 가열시 분리하기 어렵 기 때문에 끓는점이 더 높습니다.
점도
바닷물은 담수보다 점도가 높아 바닷물에서 이동할 때 더 두껍고 마찰이 더 많이 발생하는 반면 담수에서는 반대가 발생합니다. 점성이 더 높은 이유는 담수보다 미네랄과 염분이 많기 때문에 밀도가 높기 때문입니다.