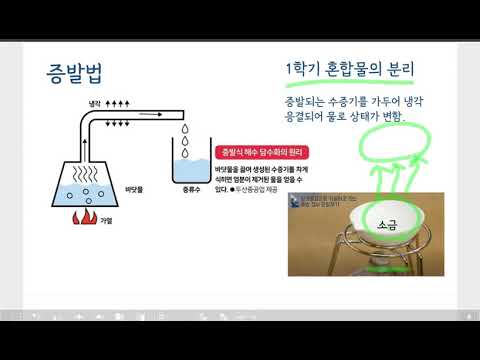
콘텐츠
지구의 대양과 바다에서 발견되는 바닷물은 강, 호수 및 개울의 담수와는 완전히 다릅니다. 동물 군과 식물 군은 생존하기 위해 적응되었지만, 둘 다 생존 할 수있는 사람은 거의 없습니다. 일부 종은 강물의 담수가 소금물과 섞여서 소금물이 희석 될 때 생기는 소금기있는 것을 용인 할 수 있습니다.

염분
아마도 가장 큰 차이는 이름 그 자체입니다. 소금물에는 소금 또는 염화나트륨이 들어 있습니다. 담수는 소량의 소금을 함유 할 수 있지만, 염수로는 충분하지 않습니다. 해양 수질의 염분은 3.5 %로 바닷물 1 리터 당 35 그램의 소금이 희석됩니다. 염분은 두 가지 유형의 물 사이의 다른 차이점을 나타내며 바닷물에서 살아남은 유기체에 대한 도전도 제공합니다. 바다 소금은 해저에서 유래 한 것일뿐 아니라 강과 시내에서 운반 된 것으로 추정됩니다.
밀도
소금물은 염화나트륨이 용해되어 있기 때문에 달콤한 물보다 밀도가 높습니다. 이것은 특정한 양의 소금물이 같은 양의 담수보다 무거울 것을 의미합니다. 그것이 소금물에 관해서라면, 온수는 감기보다 밀도가 낮아서 추운 물이 해저에 가라 앉는 결과를 낳습니다. 냉수가 더 빽빽해질 때까지, 그것이 얼 때, 그것의 조밀도는 감소하고 표면에 뜬다.
어는점
빙점의 빙점과 비등점은 담수와 관련하여 다르지만 빙점 만이 자연의 결과입니다. 염수의 평균 동결 온도는 -2 ° C이며 염분 농도가 높거나 물의 압력이 더 높으면 더 낮을 수 있습니다. 물의 전형적인 빙점은 0 ℃이다.
토닉
서로 다른 농도의 소금 또는 용질이 반투막을 따라 놓여지면 물은 농도의 균형을 맞추기 위해 용질의 농도가 가장 높은 막의 측면으로 흐르게됩니다. 물에 대해 논의 할 때, 수분은 수역 내에 사는 동물과 식물 종에 중요합니다. 소금물은 식물과 동물의 조직에있어 고칼슘 혈증입니다. 이것은 이러한 유기체가 환경에 물을 잃는다는 것을 의미합니다. 결과적으로, 그들은 끊임없이 물을 마시고 소금을 제거해야합니다. 마찬가지로, 담수는 동물 군과 식물 군에서 저농도입니다. 이 미생물은 거의 물을 마실 필요가 없지만 소금 농도의 균형을 맞추기 위해 쉽게 배출해야합니다. 이 적응은 삼투 현상으로 알려져 있습니다.