
콘텐츠
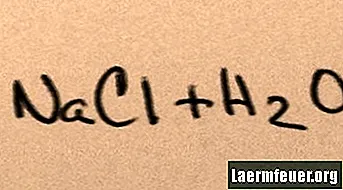
물에 소금을 첨가하면 물이 지원할 수있는 최대 염 이온이 수소와 산소 분자 주위에 떠있을 때까지 구성 분자로 용해됩니다. 이 경우 솔루션을 "포화"라고합니다. 더 많은 소금이 용해되면 나트륨과 염화물 이온이 서로 충돌하여 소금 결정으로 재결합합니다. 이 현상은 형성된 고체가 물 바닥으로 떨어지기 때문에 "강수"라고 알려져 있습니다. 소금은 "친수성"입니다. 즉, 물에 끌립니다. 이 매력은 익숙한 형태의 강수량을 촉진합니다. 구름 속의 작은 소금 결정 주위에 빗방울이 형성되어 약간 짠 맛이납니다.
기본

전해질

소금은 고체 상태에서 전기를 전도하지 않지만 유체 (액체) 상태에서는 전기를 잘 전도 할 수있는 용액을 형성합니다. 전도도는 사용되는 소금의 종류에 따라 다르지만 전해질 용액이라고하는 이러한 액체는 인체에 필요한 화합물의 우수한 운반체입니다. 뇌에서 생성 된 전기 자극은 혈액에서 사용되는 자유 산소를 생성합니다. 염분 분자는 전해질 (나트륨, 칼륨 또는 칼슘)과 용액의 염화물로 분류됩니다. 염화물은 혈액과 신장을 통해 소변으로 펌핑되고 전해질은 운동 선수가 호출하는 과정에서 신경근 시스템을 통해 분배됩니다. 재수 화.
Colligative 특성

분자의 추가는 새로운 화합물을 형성하지 않더라도 액체의 분자량을 변화시키고 그 특성에 영향을 미치기 때문에 모든 용액은 원래 조성과 다릅니다. 소금물은 순수한 물보다 밀도가 높고 더 천천히 얼기도합니다. 그러나 얼면서 소금은 액체의 한계로 이동하여 더 무겁고 포화 상태가 된 다음 어는점을 낮 춥니 다. 물질 상태의 다른 쪽 끝에서는 소금물의 밀도가 높을수록 물이 다 떨어지고 소금 층이 남을 때까지 증발하는 데 더 많은 열이 필요합니다. 요리사는 가열을 지연시키지 않기 위해 냄비의 물이 끓을 때까지 소금을 추가합니다. "결합 특성"으로 알려진 이러한 특성은 과학자들이 염수의 분자량을 결정하는 데 도움이됩니다. 액체의 질량, 대기압 및 끓는점을 측정 할 수 있다면 과학자들은 물의 분자량을 빼서 어떤 염이 존재하는지 알아낼 수 있습니다.