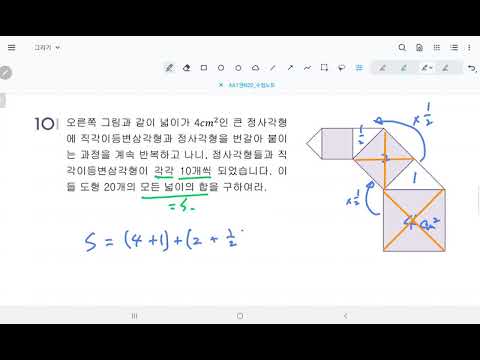
콘텐츠
전자 및 분자 기하학은 모두 화학에서 사용되는 복잡한 개념입니다. 일반적으로 유사하지만 몇 가지 근본적인 차이점이 있습니다. 주로 모든 전자의 기하학이 하나 이상의 분자 기하학과 관련되어 있습니다. 전자 기하학은 분자의 중심 원자의 전자 구조에 의존하는 반면, 분자 기하학은 중심 원자에 부착 된 원자 또는 자유 전자 쌍이 있는지 여부에 따라 달라집니다.
선형 전자 기하학
선형 전자 기하학은 180도 각도로 연결된 두 쌍의 전자가있는 중심 원자를 포함합니다. 선형 전자 기하학에 대해 가능한 유일한 분자 기하학은 선형이며 직선으로 세 개의 원자로 구성됩니다. 선형 분자 기하학을 가진 분자의 예는 이산화탄소, CO2입니다.
평면 삼각 전자 기하학
평면 삼각 전자 기하학은 평면 형태로 구성된 120도 각도로 연결된 세 쌍의 전자를 포함합니다. 원자가 세 위치에서 연결되어 있으면 분자 형태를 평평한 삼각이라고도합니다. 그러나 원자가 3 개의 전자 쌍 중 2 개에만 부착되어 자유 쌍을 남기면 분자 모양을 각도라고합니다. 각 분자 기하학은 120 도의 약간 다른 연결 각도를 생성합니다.
사면체 전자 기하학
사면체 전자 기하학은 109.5도 떨어져있는 각으로 연결된 4 쌍의 전자를 포함하여 사면체처럼 보이는 기하학을 형성합니다. 네 개의 전자 쌍이 모두 원자에 부착되어 있으면 분자 형태를 사면체라고도합니다. "피라미드 삼각"이라는 이름은 한 쌍의 자유 전자와 세 개의 다른 원자가있는 경우에 주어집니다. 원자가 두 개 뿐인 경우에는 "각도"라는 이름이 사용되며, 평평한 삼각 전자 기하학으로 중심 원자에 연결된 두 개의 원자를 포함하는 기하학이 사용됩니다.
삼각 이중 피라미드 전자 기하학
삼각 쌍뿔 전자 기하학은 5 쌍의 결합 전자를 포함하는 전자 기하학에 주어진 이름입니다. 이름은 120도 각도로 평면에 연결된 세 쌍의 모양과 평면에 대해 90도 각도로 나머지 두 쌍의 모양에서 유래하여 두 개의 피라미드가 서로 연결된 모양이됩니다. 중심 원자에 5 개, 4 개, 3 개 및 2 개의 원자가 부착 된 쌍각 삼각 삼각 전자 기하학에 대해 가능한 네 가지 분자 기하학이 있으며 각각 삼각, 접형, T 자형 및 선형 쌍 각뿔이라고합니다. 세 쌍의 자유 전자는 항상 120도 결합 각도로 세 공간을 먼저 채 웁니다.
팔면체 전자 기하학
팔면체 전자 기하학은 서로 90도 각도로 결합 된 6 쌍의 전자를 포함합니다. 중앙 원자에 6 개, 5 개 및 4 개의 원자가 부착 된 세 가지 가능한 전자 기하학이 있으며 각각 8 면체, 사각형 피라미드 및 사각형 평면이라고합니다.