콘텐츠
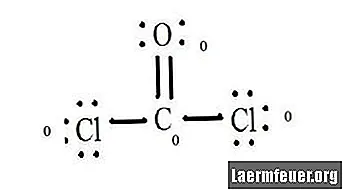
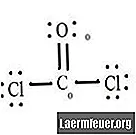
CoCl2 (포스겐 가스)와 같은 분자의 공식 전하를 결정할 때, 각 원자의 원자가 층에있는 전자 수와 분자의 루이스 구조를 알아야합니다.
원자가 껍질의 전자 수
1 단계
원자가 껍질의 전자 수를 결정하려면 원소 주기율표에서 각 원자를 찾으십시오.
2 단계
두 개의 전자는 첫 번째 하위 수준 s, 두 개는 두 번째 하위 수준 s, 여섯 개의 전자는 첫 번째 하위 수준 p에 있음을 기억하십시오. 기억하세요 : 1s (^ 2) 2s (^ 2) 2p (^ 6) 3s (^ 2) 3p (^ 6).
3 단계
부하를 누르십시오. 분자가 이온이면 전체에서 하나 이상의 전자를 더하거나 빼서 최종 전하에 도달합니다.
4 단계
CoCl2 (포스겐 가스)의 경우 : C = 4; O = 6; Cl = 7. 분자는 이온화되지 않았으며 중성 전하를 갖습니다. 따라서 원자가 껍질의 총 전자 수는 4 + 6 + (7x2) = 24입니다.
루이스 구조
1 단계
CoCl2 (포스겐 가스)의 루이스 구조 다이어그램을 참조하십시오. 루이스 구조는 분자에 대해 가장 안정적이고 가능성이 높은 구조를 나타냅니다. 원자는 한 쌍의 원자가 전자와 함께 당겨집니다. 옥텟 규칙을 만족시키기 위해 자유 전자 사이에 결합이 형성됩니다.
2 단계

각 원자와 원자가 전자를 그린 다음 필요에 따라 결합을 형성하십시오.
3 단계
염화물 원자는 탄소 분자와 단순한 결합을 공유하는 반면 산소 원자는 탄소와 이중 결합을 형성합니다. 최종 구조의 각 원자는 옥텟 규칙을 충족하고 원자가 쉘에 8 개의 전자를 가지고있어 분자 안정성을 허용합니다.
각 원자의 형식 전하
1 단계
루이스 구조에서 각 원자의 전자가없는 쌍을 세십시오. 각 원자는 그것이 참여하는 각 결합에서 전자가 할당됩니다. 그 숫자를 추가하십시오. CoCl2에서 : C = 0 개의 자유 쌍 + 4 개의 결합 전자 = 4 개의 전자. O = 자유 쌍의 전자 4 개 + 결합 전자 2 개 = 전자 6 개. Cl = 자유 쌍의 6 개 전자 + C = 7 개의 전자와 결합 된 전자 1 개.
2 단계
결합되지 않은 원자의 원자가 껍질에있는 전자 수를 뺍니다. 결과는 각 원자에 대한 공식적인 전하입니다. CoCl2에서 : C = 결합되지 않은 원자의 원자가 전자 4 개 (ev)-루이스 구조에 지정된 4 개의 전자 빼기 (LS) = 0 형식 전하 O = 6 ev-6 LS = 0 형식 전하 Cl = 7 ev-7 LS = 0 정식화물
3 단계
글을 쓸 때이 전하를 Lewis 구조의 원자 가까이에 두십시오. 분자에 총 전하가있는 경우 Lewis 구조를 괄호 안에 놓고 오른쪽 상단 모서리에 전하를 씁니다.