
콘텐츠
CoCl2 (포스겐 가스)와 같은 분자의 공식 전하를 결정할 때 각 원자의 원자가 층과 분자의 루이스 구조에서 전자의 수를 알아야합니다.
지침
-
원소의 주기율표에서 각 원자를 찾아 원자가 층의 전자 수를 결정하십시오.
-
2 개의 전자가 첫 번째 하위 레벨 s에 있고, 두 개는 두 번째 하위 레벨 s에 있고, 6 개의 전자는 첫 번째 하위 레벨 p에 있다는 점을 상기하십시오. 리콜 : 1s (^ 2) 2s (^ 2) 2p (^ 6) 3s (^ 2) 3p (^ 6).
-
짐을 쳐라. 분자가 이온 인 경우, 하나 이상의 전자를 합계에서 더하거나 빼서 최종 전하를 얻습니다.
-
CoCl2 (포스겐 가스)의 경우 : C = 4; O = 6; 분자는 이온화되지 않고 중성 전하를 띠고있다. 따라서, 원자가 층의 총 전자 수는 4 + 6 + (7 × 2) = 24이다.
원자가 층의 전자 수
-
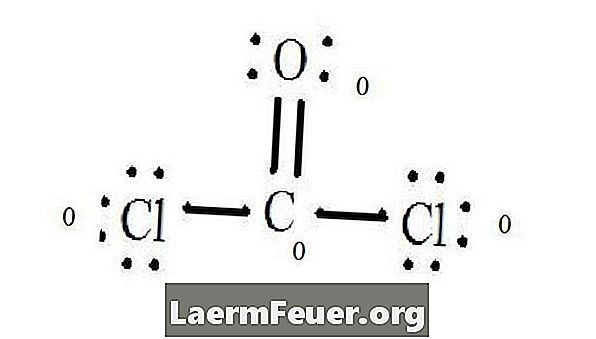
CoCl2 (포스겐 가스)의 루이스 구조도를 참조하십시오. 루이스 구조는 분자에 대해 가장 안정하고 가능성있는 구조를 나타낸다. 원자는 한 쌍의 원자가 전자로 그려진다. 옥텟 규칙을 만족시키기 위해 자유 전자들 사이에 결합이 형성된다.
-
각 원자와 그 원자가 전자를 그리고 필요에 따라 결합을 만듭니다.
루이스 구조에 그려진 전자들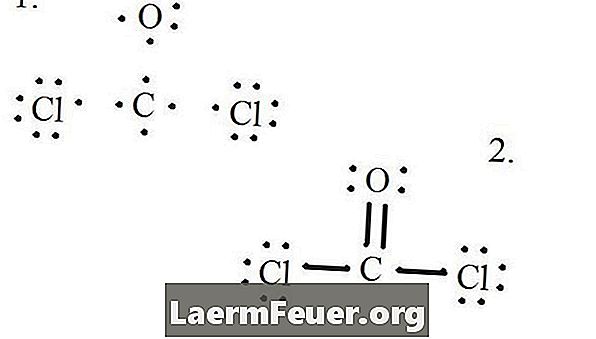
-
염화물 원자는 탄소 분자와 단일 결합을 공유하는 반면, 산소 원자는 탄소와 이중 결합을 형성합니다. 최종 구조의 각 원자는 옥텟 규칙을 충족시키고 원자가 층에 8 개의 전자를 가지므로 분자 안정성이 보장됩니다.
루이스 구조
-
루이스 (Lewis) 구조에서 각 원자의 자유 전자 쌍을 세어 라. 각 원자는 그것이 참여하는 각 결합의 전자를 나타낸다. 이 번호를 추가하십시오. CoCl2에서 : C = 0 자유 쌍 + 4 결합 전자 = 4 전자. O = 자유 쌍의 전자 4 개 + 결합 전자 2 개 + 전자 6 개. Cl = 자유 쌍의 6 전자 + C = 7 전자를 가진 한 결합의 전자.
-
결합되지 않은 원자의 원자가 층에있는 전자의 수를 뺍니다. 결과는 각 원자에 대한 공식 요금입니다. CoCl2에서 : Lewis 구조 (LS) = 0 공식적 전하 O = 6 ev - 6 LS = 0 공식적인 전하 Cl = 7 및 - 7 LS = 0에서 공식화 된 4 개의 전자를 제외한 미 결합 원자의 C = 4 원자가 전자 (ev) 0 공식 요금
원자의 공식 요금
-
기록 할 때, 루이스 구조의 원자 근처에 이러한 전하를 놓습니다. 전체 분자가 전하를 띠는 경우 오른쪽 위 모서리에 외부에 쓰여진 전하와 함께 루이스 구조를 괄호 안에 넣습니다.
각 원자의 공식 요금
공지 사항
- 전이 금속을 함유 한 분자의 공식 전하 계산은 위험 할 수 있습니다. 전이 금속의 원자가 층에있는 전자의 수는 희귀 가스 패턴에서 나온 것입니다.
필요한 것
- 주기율표